Säure
In diesem Beitrag erklären wir dir die unterschiedlichen Konzepte und Definitionen rund um das Thema der Säure.
Möchtest du das alles kurz und knapp zusammengefasst in einem Video erklärt bekommen? Dann schau dir unser Video zu den Säuren an.
Inhaltsübersicht
Säure einfach erklärt
Säuren lassen sich über verschiedene sogenannte Säure Base Konzepte erklären. Das verbreitetste Konzept ist das von Brönsted und Lowry. Es beschreibt Säuren und ihr Verhalten mit Hilfe von den Protonen. Eine Säure gibt dabei ein Proton an eine Base ab. Somit ist eine saure Verbindung ein Protonendonator. Die Donatoren können mit einem Protonenakzeptor, welche auch als Basen bezeichnet werden, zusammen reagieren. Wichtig ist, dass Protonen in der Chemie als Wasserstoffionen H+ dargestellt werden.
In der Chemie gibt es mehrere verschiedene Säure-Base Konzepte zur Beschreibung von Säuren. Die wichtigsten sind die Säure-Base Konzepte nach Arrhenius, nach Brönsted und nach Lewis.
Löst du Säuren in Wasser, so kommt es durch die Reaktion zu einer Bildung von Oxoniumionen H3O+. Mit der Hilfe der Konzentration dieser Ionen kannst du dir dann den sogenannten pH Wert errechnen. Saure chemische Verbindungen erzielen hier Werte von bis 7. Wobei 7 als neutral gilt und 0 bedeutet, dass du eine sehr starke Säure berechnet hast.
Was ist eine Säure?
Für diese chemische Verbindungen gibt es aber mehrere Säure Basen Konzepte, die sich je nach Anwendungsfall unterscheiden. Es existiert somit keine eindeutige Definition der Säure, die alle Anwendungsbereiche abdeckt.
So gehen die Säure Basen Konzepte beispielsweise darauf ein, wie sich eine Säure in Wasser oder auch ohne Wasser verhält. Auch gibt es Unterschiede in der Definition einer Säure, je nach dem, ob die Protonen oder Elektronen einer Verbindung betrachtet werden.
Im Folgenden erklären wir dir die verschiedenen Konzepte näher. Dafür schauen wir uns zunächst das von Arrhenius an, bevor wir noch einmal genauer auf das von Brönsted eingehen. Zum Schluss lernst du noch die Definition von Lewis kennen.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Arrhenius Säure
Arrhenius hat 1887 festgestellt, dass Säuren, wenn sie in Wasser gelöst sind, elektrisch leitfähig sind. Sein Konzept rund um Säuren basiert somit auf der Ionentheorie. Er stellte weiterhin fest, dass eine Säure, die in Wasser gelöst wird, sich in ein positiv geladenes Wasserstoffion und ein Säurerest als Anion aufteilt. In der Definition nach Arrhenius benötigst du aber immer Wasser als Lösungsmittel. Die Reaktionsgleichung einer Säure (HA) würde damit so aussehen. HA zerfällt in wässriger Lösung in die Ionen.
HA + H20 ⇌ H+ + A– + H20
Brönsted Säure
Wie auch im Video zu Säuren und Basen werden wir uns in diesem Artikel hauptsächlich auf die Definition von Brönsted und Lowry konzentrieren. Demnach gibt eine Säure ein Proton ab und wird dabei zu einer Base. Zusammengefasst gibt es also Protonendonatoren (Protonen abgeben) und Protonenakzeptoren (Protonen aufnehmen).
Die Definition der Brönsted Säure kannst du dir auch an der Reaktion von einer sauren Verbindung mit Wasser verdeutlichen. Zunächst unterliegt Wasser einer besonderen Reaktion, welche auch als Autoprotolyse von Wasser bezeichnet wird. Bei ihr reagiert Wasser zu einem Oxoniumion (H3O+) und Hydroxidion (OH–).
H20 + H2O  H3O+ + OH–
H3O+ + OH–
In der Reaktionsgleichung siehst du, dass die Säure Wasser ein Proton abgegeben hat und sich dadurch H3O+ gebildet hat. Außerdem konnte es ein Proton aufnehmen, was dem Verhalten einer Base entspricht. Deswegen wird Wasser auch als Ampholyt bezeichnet. Es kann sich als Base und auch als Säure verhalten. So kannst du ebenfalls festhalten, dass eine Säure in einer Reaktion mit Wasser stets H3O+-Ionen bildet. Betrachten wir als Beispiel eine Reaktion von Chlorwasserstoff (HCl) mit Wasser, wobei ersteres die Säure ist.
HCl + H2O  H3O+ + Cl–
H3O+ + Cl–
Du siehst, dass ein Proton von der Säure HCl auf das Wasser übergeht. Danach bleibt der Säurerest Cl– und das charakteristische Ion übrig.
Lewis Säure
Das nächste wichtige Säure Basen Konzept ist das von Lewis. Er beschreibt eine Säure als Elektronenpaarakzeptor. Zusätzlich ist diese, da sie Elektronen an sich zieht, elektrophil. Die Definition ist somit unabhängig von den Protonen, der jeweiligen chemischen Verbindung. Außerdem werden hier immer kovalente Bindungen zwischen den Molekülen aufgebaut. Das liegt daran, dass es hier stets um Elektronenpaare geht. Die Basen sind nach Lewis, Elektronenpaardonatoren. Eine Beispielreaktion wäre hier Aluminiumchlorid (AlCl3) als Lewis Säure und Chlorid (Cl–) als Base.
AlCl3 + Cl– 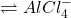
Zudem kannst du merken, dass jede Base nach Brönsted auch eine Base nach Lewis ist. Jedoch ist das bei Säuren nicht der Fall und du musst genauer nachsehen, nach welchem Konzept der Stoff eine Säure ist.
Eigenschaften Säuren
Säuren verhalten sich sehr unterschiedlich. Jedoch gibt es ein paar Eigenschaften, die man allen sauren Stoffen zuordnen kann.
Löst du eine Säure in Wasser kannst du mit der Hilfe des pH Wertes berechnen, wie sauer oder basisch die Lösung ist. Du kannst die chemischen Stoffe dann auf einer Skala von 0-14 einteilen. Wasser ist dabei neutral und hat einen Wert von 7. Eine saure Lösung ergibt Werte von unter 7 und eine basische von über 7. Wir nennen dir in dem oben verlinkten Video auch mehrere Beispiele. Wichtig ist noch, dass wenn du eine Säure in Wasser verdünnen möchtest, du die Säure immer ins Wasser gibst. Hier kommt es bei der Verdünnung zu einer exothermen Reaktion und Wärme entsteht. Würdest du daher das Wasser auf die Säure geben, wäre diese Reaktion sehr viel stärker als andersherum.
Eine zweite Eigenschaft von Säuren ist, dass diese organische Materialien, unedle Metalle und Kalk angreifen. Aufgrund dessen arbeitet man in Laboren immer mit Schutzausrüstung, wenn man Säuren behandelt. Gibst du Säuren mit Basen zusammen, so neutralisiert letzteres den sauren Stoff.
Außerdem leiten Säuren in Wasser Strom, was als Elektrolyse bekannt ist. Die letzte Eigenschaft ist, dass Säuren nicht immer als Flüssigkeiten vorliegen müssen. Beispielsweise ist die Ascorbinsäure, welche du als Vitamin C kennst, fest. Es gibt aber auch gasförmige saure Verbindungen.
Säure Base Gleichgewicht
In dem Video zu Reaktionsgleichungen hast du schon etwas über den Gleichgewichtspfeil gelernt. Diesen siehst du in der Säuren Basen Chemie öfters, da hier Hin- und Rückreaktion parallel zueinander verlaufen.
Das Gleichgewicht einer solchen Reaktion kannst du über den pKS Wert bestimmen. Allgemein gilt je höher der KS-Wert und damit je niedriger der pKS-Wert einer Säure ist, desto stärker ist der chemische Stoff. Handelt es sich um eine starke saure Verbindung so gibt diese ihre Protonen leichter ab und reagiert besser mit Wasser. Das Gleichgewicht verschiebt sich hier dann nach rechts in der Reaktionsgleichung.
Mehrprotonige Säure
Nach Brönsted und Lowry sind Säuren Protonendonatoren. Nun gibt es aber auch saure Verbindungen, die mehr als nur ein Proton abgeben können. Diese werden dann mehrprotonige Säuren genannt. Zwei Beispiele dafür wären die Phosphor- (H3PO4) und Schwefelsäure (H2SO4). Die Reaktion von Schwefelsäure mit Wasser, läuft dabei über zwei sogenannte Dissoziationsstufen ab. Je Stufe wird ein Proton abgegeben.
Erste Dissoziationsstufe:
H2SO4 + H20  H3O+ +
H3O+ + 
Nach der Reaktion hat hat Schwefelsäure ein Proton abgegeben und der Säurerest HSO4– kann in einer zweiten Dissoziationsstufe noch einmal mit Wasser reagieren:
 + H20
+ H20  H3O+ +
H3O+ + 
Oxidierende Säure
Bei der Unterteilung der sauren chemischen Stoffe in oxidierende und nicht oxidierende wird der Säurerest der Verbindung betrachtet. Eine Säure spaltet sich in das Wasserstoffion und einen Rest auf. Ist dieser Rest weiter oxidierend, das heißt entzieht er anderen Stoffen die Elektronen, dann sprichst du von einer oxidierenden Säure. Ob ein Stoff oxidierend ist kannst du an der elektrochemischen Spannungsreihe erkennen.
Saure Lösung
Wenn du ein Nichtmetalloxid in Wasser gibst entsteht eine saure Lösung. Nichtmetalloxide bilden in Zusammenhang mit Wasser als Lösung eine Säure.
Säuren im Alltag und Beispiele Säuren
Zum Schluss kannst du in diesem Kapitel viele Beispiele von Säuren und ihre Strukturformeln nachlesen. Einigen davon begegnest du auch im Alltag, wie: Wein, Fruchtsäure, Citronensäure, Apfelsäure, Essigsäure, Milchsäure, Ascorbinsäure, Kohlensäure und in der Coca Cola auch Phosphorsäure.
| Schwefelsäure | H2SO4 |
| Salzsäure | HCl |
| Salpetersäure | HNO3 |
| Phosphorsäure | H3PO4 |
| Kohlensäure | H2CO3 |
| Ammoniak | NH3 |
| Natriumhydroxid | NaOH |
| Essigsäure | CH3-COOH |
| Apfelsäure | C4H6O5 |


