Chemisches Gleichgewicht
Was verstehst du unter dem chemischen Gleichgewicht und wie hängt es mit dem Massenwirkungsgesetz zusammen? Das erklären wir dir in dem folgenden Beitrag und im Video dazu!
Inhaltsübersicht
Was ist ein chemisches Gleichgewicht?
In chemischen Reaktionen wird nach einer gewissen Zeit ein chemisches Gleichgewicht erreicht. Hierbei scheint die chemische Reaktion nicht mehr abzulaufen, da die Konzentrationen der Stoffe im Reaktionsgemisch nach einer gewissen Zeit gleich bleiben. Grundsätzlich bedeutet das bloß, dass die Hin- und Rückreaktion weiterhin mit der gleichen Geschwindigkeit ablaufen.
Im Prinzip hast du bei allen chemischen Reaktionen ein chemisches Gleichgewicht. Oft scheint die Konzentration der Produkte im Vergleich zu denen der Edukte bloß so hoch, sodass es nicht so scheint, als hättest du ein chemisches Gleichgewicht.
Bei dem chemischen Gleichgewicht scheint die chemische Reaktion äußerlich betrachtet nicht mehr abzulaufen, da sich die Konzentrationen der Stoffe im Reaktionsgemisch irgendwann nicht mehr ändern. Jedoch laufen Hin- und Rückreaktion stets weiterhin mit jeweils identischer Geschwindigkeit ab.
Gleichgewichtsreaktion
Schauen wir uns eine Gleichgewichtsreaktion zuerst mit einem anschaulichen Modellbeispiel an. Du und dein Freund haben zu Beginn 20 Fußbälle. Das Ziel bei diesem Spiel ist es, möglichst viele Fußbälle in die gegnerische Hälfte zu schießen. Nach ein paar Minuten sind in deiner Hälfte 15 und in der Hälfte deines Freundes nur noch 5 Fußbälle. Das Spiel geht weiter, aber die Anzahl der Fußbälle in den jeweiligen Hälften bleibt gleich, da beide Spieler im Schnitt gleich viele Fußbälle in die andere Hälfte schießen. Es stellt sich somit ein dynamisches Gleichgewicht ein.
Dieses sogenannte dynamische Gleichgewicht ist die Grundlage für ein chemisches Gleichgewicht, das du bei vielen Reaktionen aus der Chemie beobachten kannst.
Ein chemisches Gleichgewicht stellt sich nur bei geschlossenen Systemen ein. Du kannst beispielsweise Zink (Zn) mit Salzsäure (HCl-Lösung) zu Zinkchlorid (ZnCl2) und Wasserstoff (H2) reagieren lassen.
Zn + HCl  ZnCl2 + H2
ZnCl2 + H2
In einem geschlossenem System hast du bei dieser Reaktion eine Gleichgewichtsreaktion. Dein Wasserstoff ist bei der Reaktion immer noch in deinem Reaktionsgefäß. Du könntest die Reaktion mit hohem Druck umkehren.
Bei einem offenen System entweicht dein Wasserstoff jedoch, was eine Rückreaktion unmöglich macht.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Massenwirkungsgesetz und Gleichgewichtskonstante
Schauen wir uns das Massenwirkungsgesetz und die Gleichgewichtskonstante an. Zuerst brauchst du eine allgemeine Reaktion mit dieser Form:
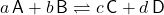
Die kleinen Buchstaben sind deine stöchiometrischen Faktoren der Reaktionsgleichung. Die großen Buchstaben stehen für die die Reaktionskomponenten.
Mit dem Massenwirkungsgesetz kannst du nun das Verhältnis der Produkte zu den Edukten deiner Gleichgewichtsreaktion berechnen. Das Verhältnis berechnest du, indem du die Konzentrationen oder die Partialdrücke der Produkte durch die der Edukte teilst.
![Rendered by QuickLaTeX.com K = \frac{\mathsf{[C]}^c \cdot \mathsf{[D]}^d}{\mathsf{[A]}^a \cdot \mathsf{[B]}^b}](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-f08bb13fd5f61772a04648d5b1505e52_l3.png)
Die Gleichgewichtskonstante  beschreibt nun das Verhältnis deiner Edukte zu den Produkten im chemischen Gleichgewicht.
beschreibt nun das Verhältnis deiner Edukte zu den Produkten im chemischen Gleichgewicht.
Ist die Gleichgewichtskonstante größer als 1, so liegt das Gleichgewicht deiner Reaktion auf Seiten des Produkts. Wenn deine Gleichgewichtskonstante kleiner als 1 ist, liegt das Gleichgewicht deiner Reaktion auf Seiten des Edukts. Sollte deine Gleichgewichtskonstante genau 1 entsprechen, liegen Edukt und Produkt im Gleichgewicht in gleicher Menge vor.
Gleichgewicht auf Produktseite, wenn  1
1
Gleichgewicht auf Eduktseite, wenn  1
1
Möchtest du sowohl zum Massenwirkungsgesetz als auch zur Gleichgewichtskonstanten noch mehr wissen, dann schau dir unsere beiden Videos zu diesen Themen an!
Chemisches Gleichgewicht Aufgaben
Mit dem Massenwirkungsgesetz kannst du nun die Gleichgewichtskonstante einer Reaktion berechnen. Am besten gucken wir uns das an einem konkreten Beispiel an:
In der Beispielreaktion reagiert Nitrosylchlorid (ONCl) zu Stickstoffmonoxid (NO) und Chlor (Cl2).
2 ONCl  2 NO + Cl2
2 NO + Cl2
Die Gleichgewichtskonzentrationen der Reaktionskomponenten bei einer Temperatur von 500 K sind [NO] = 0,91  , [ONCl] = 0.09
, [ONCl] = 0.09  und [Cl2] = 0,045
und [Cl2] = 0,045  . Nun sollst du daraus die Gleichgewichtskonstante berechnen.
. Nun sollst du daraus die Gleichgewichtskonstante berechnen.
Du stellst immer zuerst das Massenwirkungsgesetz für die jeweilige Reaktion auf und setzt anschließend deine Konzentrationen im chemischen Gleichgewicht ein.
Aufstellen des Massenwirkungsgesetzes
Das Massenwirkungsgesetz sieht nun folgendermaßen aus:
![Rendered by QuickLaTeX.com K = \frac{\mathsf{[NO]}^2 \cdot \mathsf{[Cl_2]}}{\mathsf{[ONCl]}^2}](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-8042e87472c158501c3a84bc3e989c48_l3.png)
Wichtig: Dabei darfst du nicht vergessen, die stöchiometrischen Koeffizienten mit aufzunehmen.
Gleichgewichtskonstante berechnen
Du setzt jetzt deine Werte der Gleichgewichtskonzentrationen in das Massenwirkungsgesetz ein. Deine Gleichgewichtskonstante, die du am Ende bekommst, hat keine Einheit.
![Rendered by QuickLaTeX.com K = \frac{\mathsf{[NO]}^2 \cdot \mathsf{[Cl_2]}}{\mathsf{[ONCl]}^2} = \frac {0,91 \mathsf{\frac{mol}{L}}^2 \cdot 0,045 \mathsf{\frac{mol}{L}}}{0,09 \mathsf{\frac{mol}{L}}^2}](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-e003b66ac1209fb7e8222bb5d57b16a1_l3.png) = 4,6
= 4,6
Deine Gleichgewichtskonstante hat den Wert 4,6. Der Wert ist deutlich größer als 1. Somit liegt das Gleichgewicht bei 500 K deutlich auf Seiten des Produkts.
Chemisches Gleichgewicht beeinflussen
Gucken wir uns zum Schluss an, wie du ein chemisches Gleichgewicht eigentlich beeinflussen kannst. Eine ganz klassische Reaktion ist das Haber-Bosch-Verfahren . In diesem Verfahren reagiert Stickstoff (N2) mit Wasserstoff (H2) zu Ammoniak (NH3).
N2 + 3 H2  2 NH3
2 NH3
Beim Haber-Bosch-Verfahren soll die Ausbeute an Ammoniak möglichst hoch sein. Du hast nun verschiedene Möglichkeiten, dein chemisches Gleichgewicht zu beeinflussen.
Einerseits beeinflusst die Temperatur dein chemisches Gleichgewicht. Hierbei ist es wichtig, ob bei deiner Reaktion Energie freigesetzt (exotherm) wird oder Energie aufgenommen (endotherm) wird. Bei einer exothermen Reaktion verschiebt sich dein chemisches Gleichgewicht auf die Eduktseite. Bei einer endothermen Reaktion verschiebt sich dein chemisches Gleichgewicht auf die Produktseite.
Das Haber-Bosch-Verfahren ist ein exothermer Prozess. Eine Temperaturerhöhung führt zu einer verminderten Bildung von Ammoniak.
Du kannst dein chemisches Gleichgewicht auch mit Druck steuern. Erhöhst du deinen Druck, so reagiert dein System in die Richtung, in der weniger Gasteilchen vorhanden sind.
Beim Haber-Bosch-Verfahren würde eine Druckerhöhung dazu führen, dass mehr Ammoniak gebildet werden würde. Du hast bei deinen Edukten nämlich vier, bei deinem Produkt nur zwei Gasteilchen. Der erhöhte Druck sorgt dafür, dass dein System dem Zwang des Drucks ausweichen möchte. Dadurch reagiert dein System in die Richtung, in der weniger Gasteilchen vorhanden sind.
Möchtest du bei einer Gleichgewichtsreaktion möglichst große Mengen an Produkt herstellen, änderst du Temperatur und Druck so, dass dein Gleichgewicht dem Zwang in Produktrichtung ausweicht.
Die Beeinflussung des chemischen Gleichgewichts fasst du auch unter dem Begriff des Prinzips von Le Chatelier zusammen.
